
La validación 3Q (IQ/OQ/PQ) es una parte fundamental de la validación del diseño de dispositivos médicos, con el objetivo de verificar sistemáticamente la conformidad y la fiabilidad de todo el proceso, desde la producción hasta el rendimiento. A continuación, analizamos los elementos clave de verificación 3Q para las características de la laparoscopia de un solo usoDispositivo de riego y de aspiraciónEvitar citar datos que no pueden garantizar la precisión y optimizar la lógica de presentación.

I. IQ (confirmación de la instalación)
Objetivo: verificar que el equipo de producción, el ambiente y el sistema de documentación cumplan con los requisitos de diseño.
Factores clave:
Instalación y calibración de equipos
La ubicación de la instalación, la configuración de la fuente de energía y gas de los equipos clave (por ejemplo, máquinas de molpor inyección, líneas de montaje) deben cumplir con los requisitos de los documentos técnicos.
Calibrar sensores e instrumentos relacionados con la producción (por ejemplo, sensores de presión, medidores de flujo, controladores de temperatura) para asegurar que su precisión cumpla con los requisitos del proceso.
Confirmación del entorno de producción
Confirmar que el control de limpieza, temperatura y humedad del entorno de producción cumple con los requisitos del proceso del producto y los requisitos reglament(por ejemplo, para evitar la contaminación y el riesgo de contaminación cruzada).
Los registros de monitoreo ambiental deben ser completos, incluyendo, pero no limitándose al control de partículas, carga microbiana y otros parámetros básicos.
Auditoría del sistema de documentación
Confirme que los PNT de los equipos, los registros de mantenimiento, los dibujos de diseño y la lista de materiales (BOM) están completos y en versiones controladas.
Revisar los documentos de calificación de proveedores de materias primas (por ejemplo, certificados de calidad, informes de biocompatibilidad) para asegurar el cumplimiento de la cadena de suministro.
II. OQ (cualificación profesional)
Objetivo: verificar la capacidad de los equipos y procesos para operar de manera estable bajo parámetros establecidos.
Factores clave:
Parámetro de proceso prueba de límite
Verifique los límites superior e inferior de los parámetros del proceso de moldeo por inyección (por ejemplo, temperatura, presión, tiempo) para asegurarse de que la silicona está totalmente vulcanizada y libre de defectos (por ejemplo, burbujas de aire, bajo vulcani).
Pruebe la consistencia de los lotes de la producción de moldes multicavidad para garantizar que las dimensiones críticas del producto (por ejemplo, diámetro de la cavidad, tamaño de la interfaz) cumplan los requisitos de diseño.
Validación de componentes funcionales
Prueba de sellado: verifique el rendimiento de sellado del atractor de descarga a través de la prueba de retención de presión para asegurar que no haya fugas.
Validación de la función de la válvula: pruebe la velocidad de respuesta y la repetibilidad del modo de enjuague/sucpara confirmar su fiabilidad.
Capacidad de Control de procesos
Evaluar la estabilidad del proceso de los parámetros clave del proceso (por ejemplo, analizar la distribución de datos a través de métodos estadísticos) para asegurar la robustez del proceso.
Verificar la eficacia de los sistemas de inspección en línea (por ejemplo, inspección visual, pruebas de presión) para asegurar la capacidad de detección de defectos.
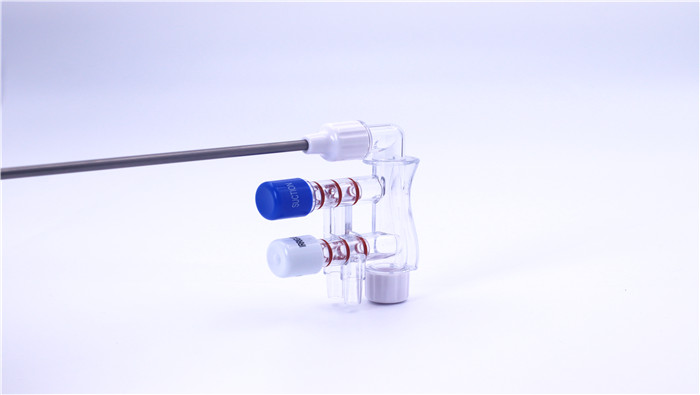
III. PQ (cualificación profesional)
Objetivo: verificar que el desempeño del producto final cumpla con las necesidades clínicas y requisitos regulatorios.
Factores clave:
Evaluación de biocompatibilidad
Completar las pruebas de biocompatibilidad necesarias de acuerdo con las normas internacionales (por ejemplo, la serie ISO 10993), incluyendo elementos básicos como citotoxicidad y sensibilización.
Verificar la seguridad química (por ejemplo, disolución, residuos) de los componentes en contacto con el paciente.
Esterilización y validación de envases
Validez de la esterilización: confirme el nivel de garantía de esterilidel proceso de esterilización mediante la prueba de bioindicadores.
Control de residuos: garantizar que los residuos de esterilización (por ejemplo, óxido de etileno) cumplan los requisitos de las normas internacionales pertinentes.
Integridad del embalaje: verificar el sellado y la barrera bacteriana del embalaje durante la fecha de caducidad a través de la prueba de envejecimiento acelerado.
Ensayo de simulación de la función clínica
Verificación del rendimiento de fluidos: simulación de escenarios quirúrreales para probar la estabilidad del flujo de lavado y la presión negativa de suc.
Prueba de fatiga: simulación de múltiples escenarios de uso (por ejemplo, enchufe y desenchufe repetidos, conmutación de modo) para verificar la durabilidad de los instrumentos.
Prueba de condición extrema: evaluar la confiabilidad funcional de los instrumentos en ambientes no ideales (por ejemplo, baja temperatura, alta temperatura).
Gestión de riesgos y sistema de trazabilidad
Identifique los puntos de riesgo clave (por ejemplo, fallo del sello, adherencia de la válvula) a través de herramientas de análisis de riesgo (por ejemplo, FMEA) y desarrolle medidas de control.
Establecer un sistema completo de trazabilidad de los lotes de producción para garantizar la trazabilidad de toda la cadena, desde las materias primas hasta los productos acabados.

IV. La integración y salida de la verificación 3Q
Gestión de la integridad de los datos
Asegurar que todos los datos de las pruebas sean rastreables y revisables, en línea con los principios básicos de integridad de datos (por ejemplo ALCOA).
Presentación de informes y examen
Generar informes de validación de IQ/OQ/PQ, documentación de manejo de desviaciones y acciones correcy preventivas (CAPA), y su aprobación por el departamento de calidad.
Mejora continua
Optimice los parámetros del proceso o los detalles del diseño basándose en los resultados de validación, actualice la documentación técnica y los documentos de gestión de riesgos.
conclusión
La validación 3Q de los dispositivos desechde riego y succión laparodebe centrarse en "conformidad del equipo - robustez del proceso - confiabilidad del producto", y el núcleo es probar la conformidad general de su diseño, producción y rendimiento a través de métodos científicos. Las empresas deben centrarse en el rigor de la lógica de validación y evitar confiar en ella
+86 18361958211
marketing@cndonho.com
+86 18361958211
No.2 Zhiwei Road, Qiandeng Town, Kunshan City, Jiangsu Province, China




